科研进展
ACS Pharmacology & Translational Science | 一石三鸟:黄牛实验室利用反向共价对接筛选方法发现老药Entacapone的新靶标KEAP1
1988年诺贝尔生理学和医学奖获得者Sir James Black 有一句名言: ‘The most fruitful basis of the discovery of a new drug is to start with an old drug’。发现一个老药的新靶点或作用机制,对于药理学家而言,就像生物学家发现一个基因或蛋白的新功能一样重要。
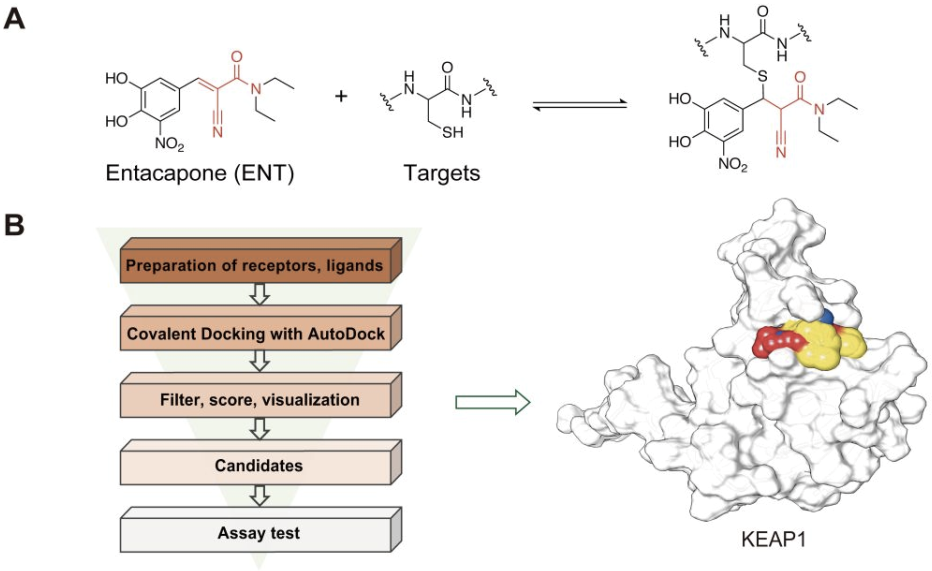
恩他卡朋(Entacapone)是一种儿茶酚-O-甲基转移酶(COMT)抑制剂,已被安全用于治疗帕金森病(与左旋多巴联用)超过20年。黄牛实验室2019年的研究发现Entacapone可以作为脂肪量和肥胖相关蛋白(FTO)的抑制剂;晶体学研究和构效关系研究表明,Entacapone通过非共价的方式与蛋白靶标COMT和FTO结合。然而,Entacapone结构中含有一个明显的迈克尔受体,即亲电的氰基丙烯酰胺基团,近几年越来越多的研究表明,氰基丙烯酰胺基团能够可逆地修饰蛋白上的半胱氨酸残基。加上我们实验室和其他实验室也都注意到,Entacapone中的氰基丙烯酰胺基团具有很好的反应活性,药物分子中含有如此明显的结构特点,就自然而然地令人好奇其是否在细胞内存在共价结合靶标。
然而,氰基是一个很强的吸电子基团,使得目前常用的丙烯酰胺反应弹头和巯基反应后,产生了不稳定的中间体,因而赋予了丙烯酰胺共价弹头一种很好的可逆性质。基于该策略设计出来的BTK可逆共价抑制剂也处于临床研究中。虽然这种可逆性被认为可以降低不可逆抑制剂带来的潜在off-targets影响,但同时也给研究增加了很大难度。区别于不可逆抑制剂的是,可逆共价分子与靶标之间的结合是可解离的,因而直接采用蛋白组水平的共价靶标筛选的方法来对Entacapone潜在的共价靶标进行搜寻充满挑战。那么,面对这样一个问题,既然湿试验存在技术难度,能否转换思路,采用计算模拟方法来寻找一些线索呢?
2024年2月13日,北京生命科学研究所/清华大学生物医学交叉研究院黄牛实验室,在美国化学会ACS Pharmacology & Translational Science杂志上发表题为“Structure-Based Identification of Kelch-like ECH-associated Protein 1 as a Pharmacological Target of Electrophile Containing Catechol-O-methyltransferase Inhibitors”的文章。该研究从收集的人源蛋白靶标-半胱氨酸共价配体结构数据出发,用基于计算模拟的反向共价分子对接的策略,对包含有亲电基团的COMT抑制剂 Entacapone,Nitecapone分别对125个已知可以结合共价配体的靶标进行共价对接,结合实验验证,发现KEAP1是这类药物的潜在共价结合靶标,并在体外、体内验证了其活性(图1)。为靶向调节KEAP1/NRF2这一与多种慢性疾病高度相关的通路,提供了新型结构的调控剂;另外,Nitecapone 结构中的双乙酰基也是一个新颖的可逆共价弹头。
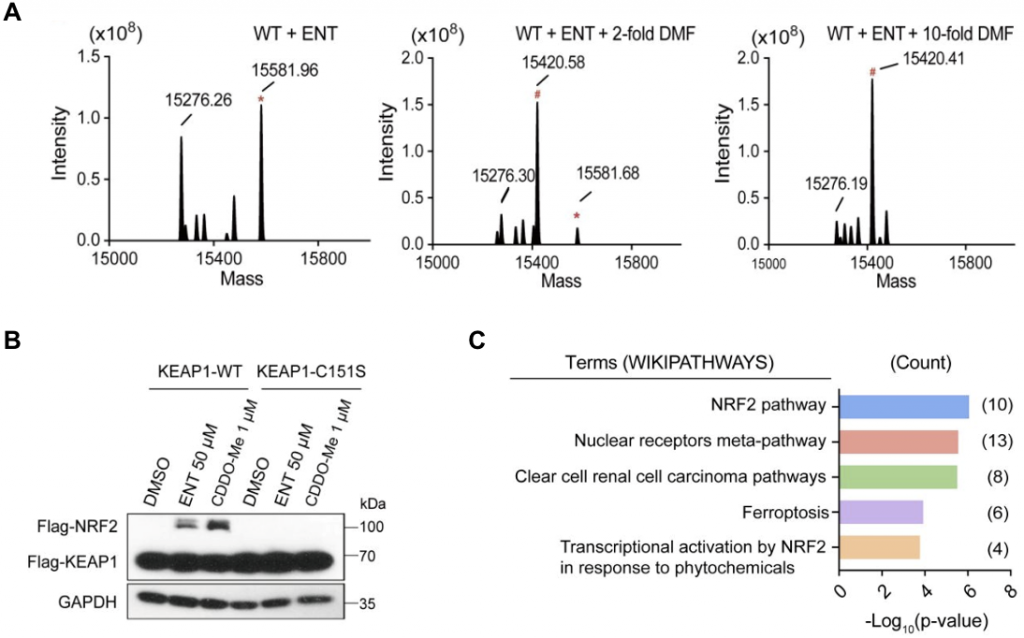
生化实验结果表明,Entacapone与KEAP1-BTB C151通过可逆共价的方式结合,MS结果显示当加入不可逆的抑制剂DMF后,Entacapone对KEAP1-BTB的修饰消失,从而证明了共价可逆性的存在(图2)。突变C151位点、或者去掉或降低Entacapone的反应活性,都会降低其与KEAP1-BTB的结合能力。进一步的细胞实验显示,Entacapone可以通过结合KEAP1-C151来稳定NRF2蛋白水平,并能促进NRF2的入核,进而激活NRF2下游通路。
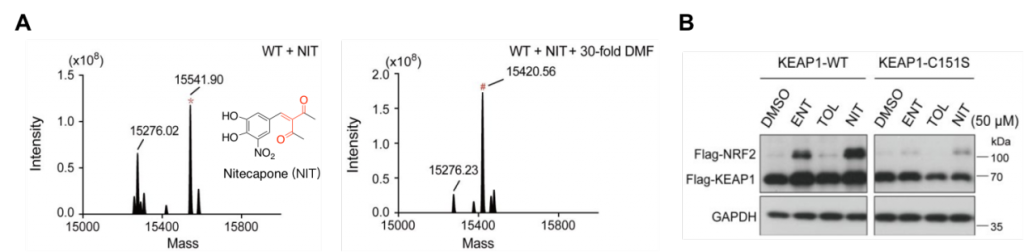
此外,我们还发现另一种含有亲电基团的 COMT 抑制剂,Nitecapone,通过新颖的3-亚甲基乙酰丙酮弹头与KEAP1结合(图3)。有趣的是,双乙酰基团的存在,使得Nitecapone表现出了与单乙酰基不同的性质,也具有了可逆共价的特征。生化实验也验证了其高度依赖于KEAP1-BTB C151位点来可逆共价结合KEAP1,并在细胞中激活KEAP1/NRF2通路。
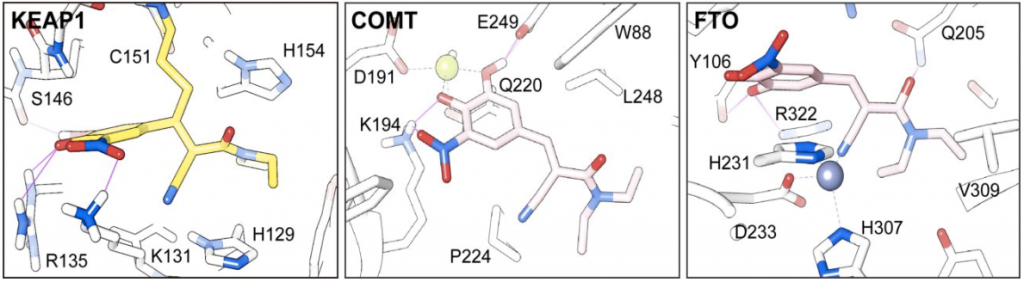
令人惊讶的是,Entacapone可以以截然不同的结合方式与不同的蛋白质靶标相互作用,展示了一个多靶标配体采用的有趣的结合特性,对理性设计多靶标配体具有显著的启示意义(图4)。在KEAP1-entacapone的分子对接模型中,除了氰基丙烯酰胺与C151形成的共价键外,硝基儿茶酚环上的间位羟基与S146形成了氢键,脱质子化的邻位羟基与R135形成了电荷-电荷相互作用,硝基与K131相互作用。然而,在COMT-entacapone模型中,硝基儿茶酚部分与金属离子形成螯合,类似于其他类型的COMT抑制剂在晶体结构中的作用模式。与此形成鲜明对比的是,在entacapone与FTO结合的复合物晶体结构中,氰基与结合位点的金属离子形成螯合,而硝基儿茶酚环上的间位羟基则与结合位点的R322和Y106形成氢键。
通过调节 KEAP1 激活 NRF2,可以在包括慢性肺病和肝病、自身免疫性疾病、神经退行性疾病等多种疾病紊乱和代谢紊乱中显示出治疗潜力。虽然NRF2的小分子激活剂被广泛研究,目前只有两种药物DMF和RTA-408获得FDA批准用于治疗多发性硬化症和弗里德赖希共济失调,可用药物和适应症仍然十分有限。因此,开发调节KEAP1/NRF2通路的新骨架分子仍然有重要的临床价值。
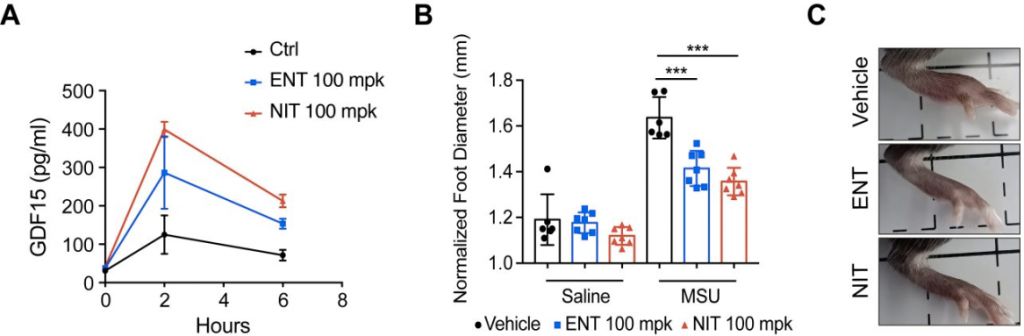
基于以上实验结果,我们进一步检测了Entacapone和Nitecapone在小鼠体内的活性(图5)。在分离诱导的BMDMs细胞中,我们发现Entacapone或者Nitecapone处理后,能激活受NRF2调节的下游AREs元件,并且在COMT或者FTO KO的细胞中仍然能够激活NRF2下游,说明Entacapone和Nitecapone在这条通路上不依赖于COMT或FTO发挥作用。更进一步,我们用Entacapone或者Nitecapone处理小鼠,在血液中也检测到了受NRF2调节的下游GDF15的蛋白水平的上升。并且,在MSU诱导的风湿性关节炎小鼠模型中,经Entacapone或者Nitecapone处理后可以明显缓解炎症症状;此外,我们发现药物Entacapone对肝中NRF2下游激活更明显,而Nitecapone对肾中NRF2下游激活更明显。药物在组织中分布的数据显示,这种不同组织的激活趋势同药物的组织分布吻合。
综上,我们的研究亮点:
- 基于反向共价对接,我们发现Entacapone这类含有亲电基团的COMT抑制剂,以可逆共价的方式结合KEAP1,展示了一种药物以不同结合方式结合不同靶标的现象。
- 我们发现了Nitecapone中3-亚甲基-乙酰丙酮结构单元是一种新型的可逆共价弹头,具有进一步开发应用的潜力。
- Entacapone和Nitecapone在体外、体内实验中,均表现出对KEAP1/NRF2通路中抗氧化应激元件基因表达的激活。
- 这两种药物分子在小鼠急性痛风模型中表现出抗炎活性,表明它们是一类新型的口服有效的KEAP1可逆共价结合分子。
- 提供了在结构蛋白组学水平研究可逆共价的范式示例。
Entacapone自最初靶向COMT一举成名,后来又发现它同时是FTO抑制剂,现在又被发现可以作为KEAP1调节剂。我们对于事物的认知,总是随着科学的不断探索而拓展和深入,与此同时,计算方法和工具也赋予了我们更理性和更经济的优势。新药研发纷繁复杂却又充满魅力,其中小分子药物的多靶标作用是特色所在,它们是”一专多能”,还是”功过参半”,取决于严谨的靶点和作用机制的科学研究。拓展小分子化合物的新化学空间是目前热点,但从已有药物的化学空间拓展新靶点也是必不可少的,两者相辅相成,相得益彰。Entacapone的一石三鸟,可能只是这个故事的开始。
黄牛实验室的博士研究生王平与李杨博士为本文共同第一作者,黄牛博士为通讯作者。其他作者包括黄牛实验室的杨仅亦,李子问博士,任欣桐,李鹏飞,秦鹿柘,谢钰婷,侯楠楠;以及中国农业科学院孟庆石博士;瑞璞鑫(苏州)生物科技有限公司的李伟博士;该研究工作还得到了NIBS蛋白质中心和代谢组学中心的支持。该研究由北京市科委(Z201100005320012)和清华大学共同资助。